Содержание
- 2. Положение металлов в ПСХЭ 2. Строение атомов металлов и веществ металлов 3. Взаимосвязь строения металлов и
- 4. 1.Положение металлов в ПСХЭ Д. И. Менделеева
- 5. 1.Положение металлов в ПСХЭ Д. И. Менделеева
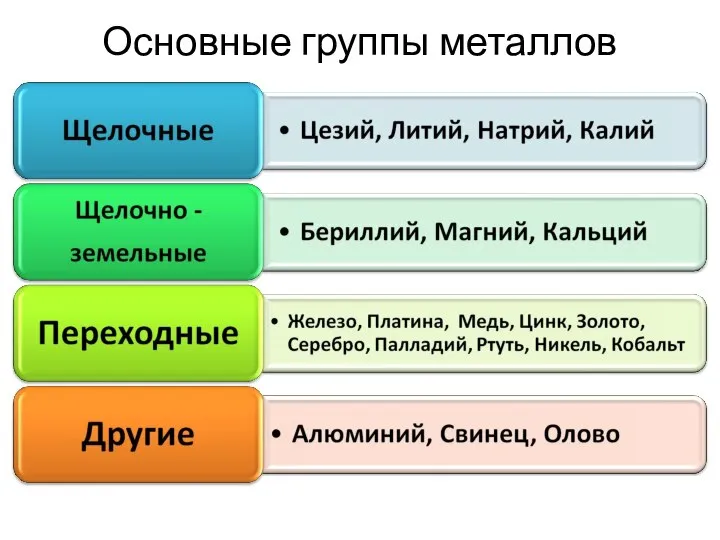
- 6. Основные группы металлов
- 7. 1.Положение металлов в ПСХЭ Д. И. Менделеева К элементам - металлам относятся: s - элементы I
- 8. 2.Строение атомов металлов и веществ металлов Из положения в таблице Д.И. Менделеева следует: Атомы металлов на
- 9. 2. У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны. Металлы в
- 10. Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической
- 11. Кристаллическая решетка в металлах
- 12. Модели кристаллов металлов: Кубическая объёмноцентрированная По этому типу кристаллизуются Li, Na, K, Rb, Cs, Ba, Fe
- 13. Кубическая гранецентрированная По этому типу кристаллизуются Са, Sr, Al, Pb и другие. Плотность упаковки в ней
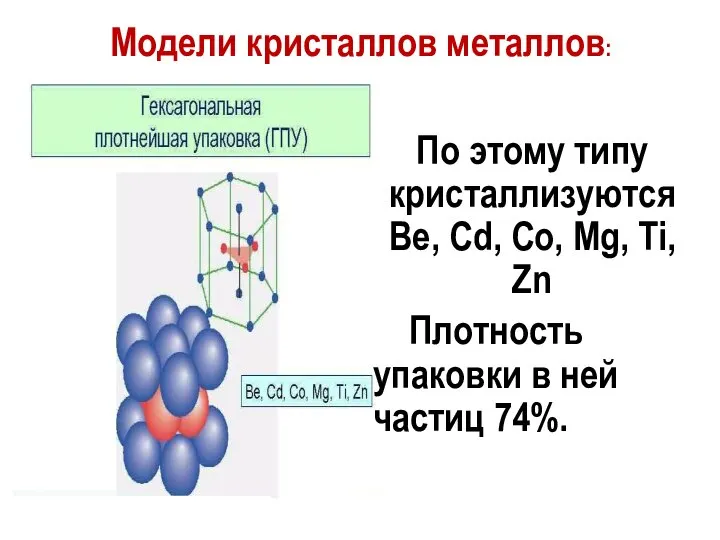
- 14. Модели кристаллов металлов: По этому типу кристаллизуются Be, Cd, Co, Mg, Ti, Zn Плотность упаковки в
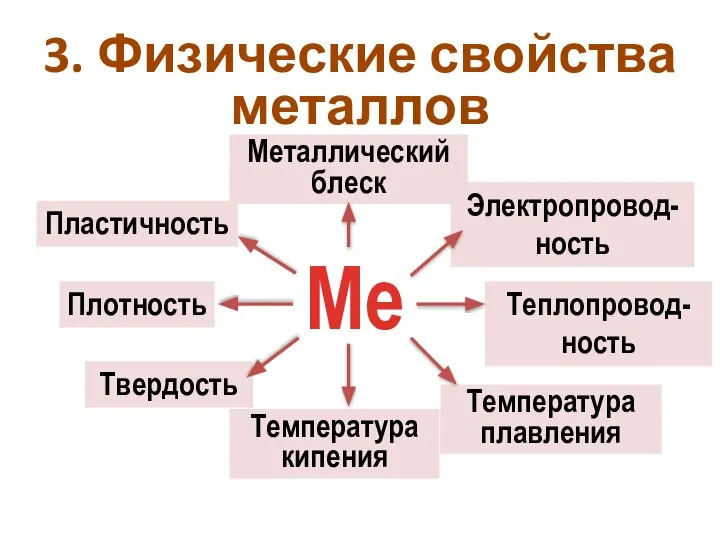
- 15. Температура плавления Ме Металлический блеск Теплопровод-ность Электропровод-ность Температура кипения Твердость Плотность Пластичность 3. Физические свойства металлов
- 16. 3. Физические свойства металлов 1. Металлический блеск Самые блестящие металлы – Hg, Ag, Pd. В порошке
- 18. 3. Физические свойства металлов Наименьшая электропроводность в ряду: Mn → Pb → Hg. В ряду: Ag→Cu
- 20. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической
- 21. Высокие теплопроводность и электропроводность
- 22. 3. Физические свойства металлов 3. Температуры плавления и кипения Калий Вольфрам Ртуть
- 23. 3. Физические свойства металлов 3. Температуры плавления и кипения Самый легкоплавкий металл – ртуть (т.пл. =
- 24. 3. Температуры плавления и кипения
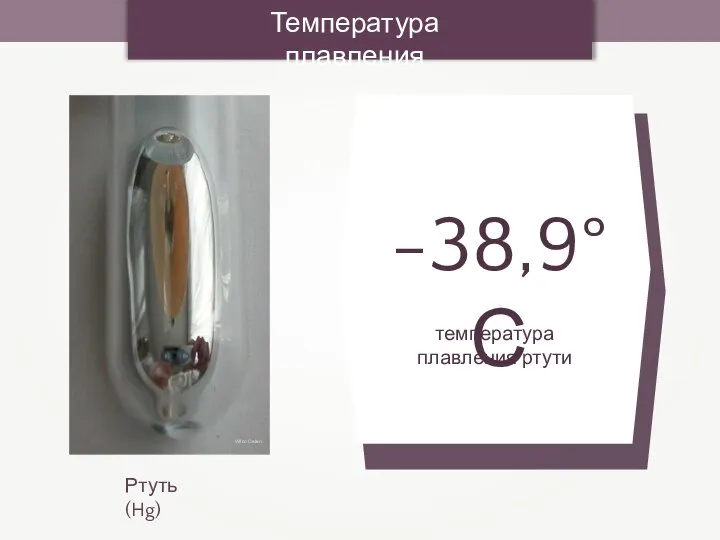
- 25. Температура плавления Ртуть (Hg) Wilco Oelen
- 26. Температура плавления Цезий (Cs) Галлий (Ga) 29°C 29,8°C Aiyizo Dnn87
- 27. Температура плавления Вольфрам (W)
- 28. Нить накаливания
- 29. 4. Твёрдость Самый твердый – хром (режет стекло). Самые мягкие – щелочные металлы – калий, натрий,
- 30. 3. Физические свойства металлов 4. Твёрдость Щелочные металлы режутся ножом
- 31. Хром – самый твёрдый металл
- 32. Твёрдость Alchemist-hp Хром (Cr)
- 33. Твёрдость Калий (K) Рубидий (Rb) Цезий (Cs) Dnn87 Dnn87 Dnn87
- 34. 4. Твёрдость
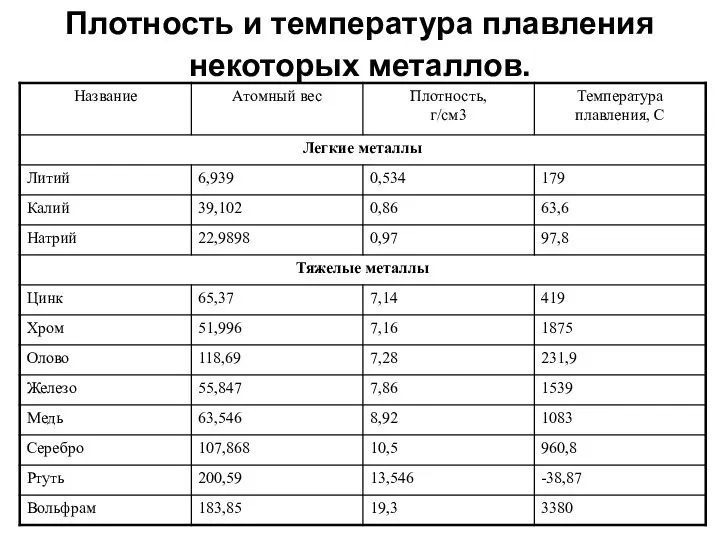
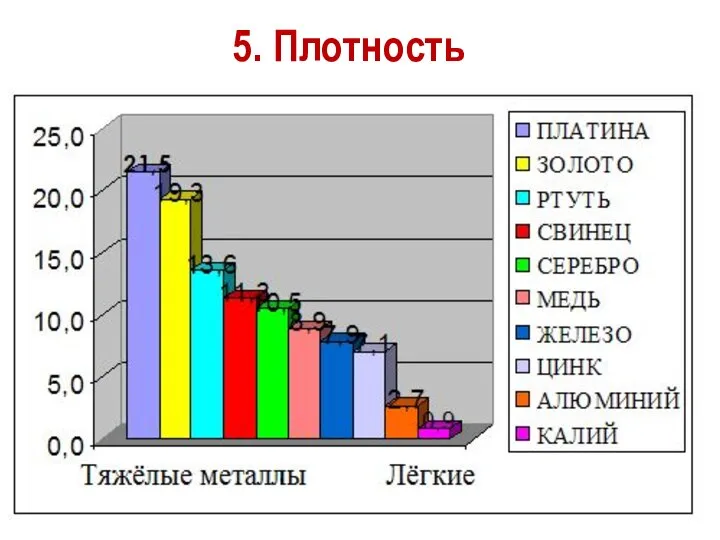
- 35. Плотность тем меньше, чем меньше атомная масса металла и чем больше радиус его атома 5. Плотность
- 36. Самый легкий – литий (ρ =0,53 г/см3), всплывает в керосине. Самый тяжелый – осмий (ρ =22,6
- 37. Плотность и температура плавления некоторых металлов.
- 38. Литий – самый лёгкий металл
- 39. Осмий – самый тяжёлый металл Осмий – самый дорогой металл (изотоп 187)
- 40. 5. Плотность
- 41. 6. Пластичность Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы.
- 42. Сусальное золото
- 43. Выводы : Все металлы имеют металлическую кристаллическую решетку. В металлах осуществляется металлическая связь. Основные физические свойства
- 44. Химические свойства металлов
- 45. Химические реакции металлов
- 46. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы одного из
- 47. Реакции соединения — это такие реакции, в результате которых из одного или нескольких веществ образуется одно
- 48. По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят
- 49. В общем виде можно выразить схемой: Ме0 – ne → Me+n Ме – металл – простое
- 50. Металлы способны отдавать свои валентные электроны атомам неметаллов, ионам водорода, ионам других металлов, а поэтому будут
- 51. Взаимодействие с простыми веществами С кислородом большинство металлов образует оксиды – амфотерные и основные: 4Li +
- 52. Взаимодействие с простыми веществами С галогенами металлы образуют соли галогеноводородных кислот: Cu + Cl2 = CuCl2
- 53. С серой металлы образуют сульфиды – соли сероводородной кислоты: Взаимодействие с простыми веществами Zn + S
- 54. Если металл реагирует с кислотой, то он входит в состав образующейся соли. Когда металл взаимодействует с
- 55. Me - ne → Me В химических реакциях металлы способны отдавать электроны, т.е. быть восстановителями, проявлять
- 56. Взаимодействие металлов с неметаллами 2Mg + О2 = 2MgО t 0 0 +2 -2
- 59. Взаимодействие металлов с неметаллами с образованием солей 2Al + 3Br2 = 2AlBr3 0 0 +3 -1
- 60. Опыт взаимодействия алюминия с серой
- 61. Опыт взаимодействия алюминия с серой
- 62. Взаимодействие алюминия с серой 2Al + 3S = Al2S3 0 0 +3 -2 Окислитель
- 63. Практическое занятие
- 64. Взаимодействие металлов с разбавленными кислотами Электрохимический ряд активности металлов вытесняют водород из кислот водород из кислот
- 65. Взаимодействие цинка с соляной кислотой Zn + 2HCl = ZnCl2 + H2↑ +1 0 +2 0
- 66. Цинк (Zn)
- 67. Взаимодействие металлов с кислотами Электрохимический ряд активности металлов взаимодействуют с разбавленными кислотами реагируют с концентрированными кислотами
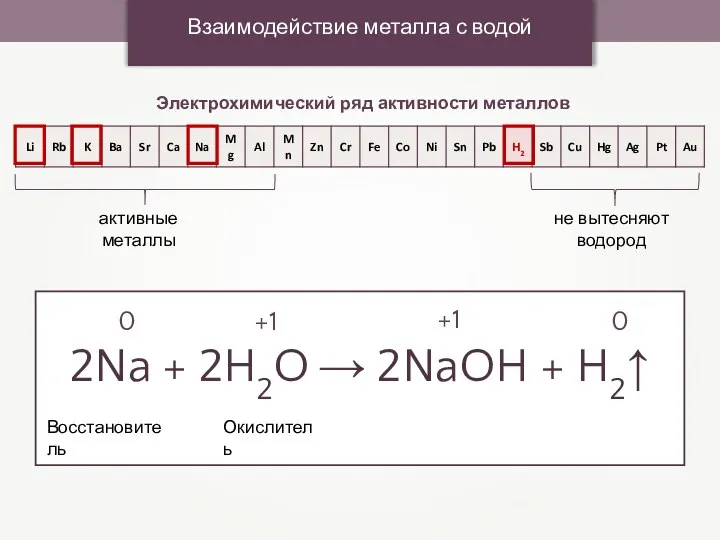
- 68. Взаимодействие металла с водой Электрохимический ряд активности металлов активные металлы 2Na + 2H2O → 2NaOH +
- 69. Взаимодействие металлов с растворами солей Электрохимический ряд активности металлов взаимодействуют с растворами солей Cu + 2AgNO3
- 70. Медь (Cu) Взаимодействие меди с нитратом серебра
- 71. Взаимодействие меди с нитратом серебра Cu + 2AgNO3 = Cu(NO3)2 + 2Ag Окислитель Восстановитель
- 72. Электрохимический ряд активности металлов
- 74. Скачать презентацию
































































 Презентация по Химии "Сера" - скачать смотреть
Презентация по Химии "Сера" - скачать смотреть  Углерод. Физические свойства
Углерод. Физические свойства Перечень практических навыков по общей химии для экзамена
Перечень практических навыков по общей химии для экзамена Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Анти-краун-эфиры
Анти-краун-эфиры Биохимические механизмы регуляции численности. (Лекция 3)
Биохимические механизмы регуляции численности. (Лекция 3) Характеристики элемента по его положению в ПСХЭ Д.И.Менделеева
Характеристики элемента по его положению в ПСХЭ Д.И.Менделеева История получения алюминия и его применение
История получения алюминия и его применение Савченко Анна
Савченко Анна  Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Эффект Зеемана
Эффект Зеемана Кинетика
Кинетика Виды химической связи (11 класс) - презентация_
Виды химической связи (11 класс) - презентация_ Строение углеводородов
Строение углеводородов A laboratory examination of double replacement reaction
A laboratory examination of double replacement reaction Неотъемлемый «аксессуар» современного человека
Неотъемлемый «аксессуар» современного человека Дикарбоновые кислоты
Дикарбоновые кислоты Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»
Посуда, ее виды и использование. Работу выполнила Гливинская Анастасия ученица 9 класса МБОУ «СОШ №11»  Щелочные породы среднего состава
Щелочные породы среднего состава Heterogeneous catalysis
Heterogeneous catalysis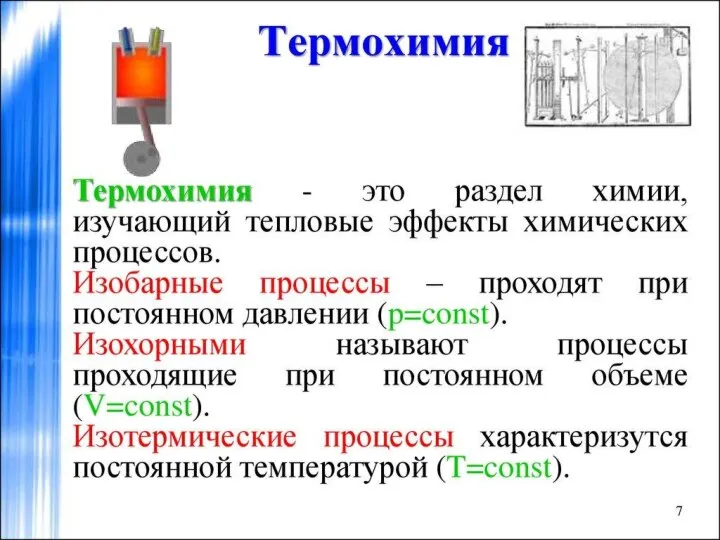 Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Окислительно-восстановительные равновесия и процессы
Окислительно-восстановительные равновесия и процессы Электролитическая диссоциация
Электролитическая диссоциация Аттестационная работа. Программа кружка по химии Юный химик
Аттестационная работа. Программа кружка по химии Юный химик Геометрия молекул
Геометрия молекул Дослідження методів очищення висококольорових поверхневих вод
Дослідження методів очищення висококольорових поверхневих вод Технология кварцевого стекла
Технология кварцевого стекла Натуральный комплекс минералов
Натуральный комплекс минералов