Содержание
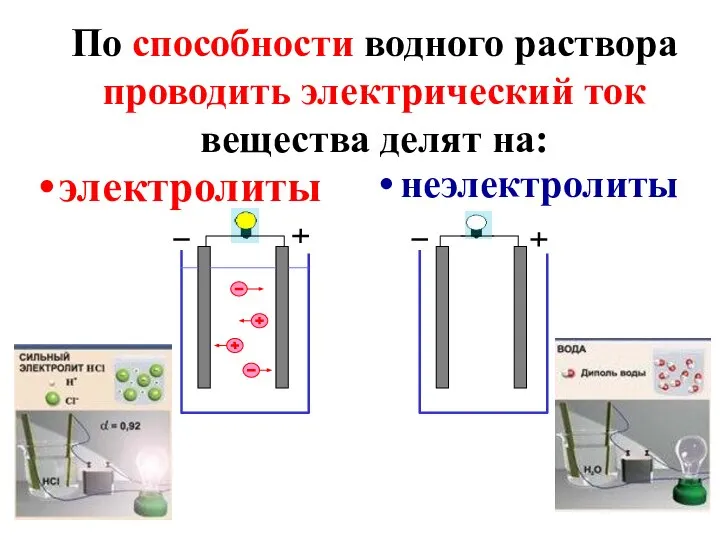
- 2. По способности водного раствора проводить электрический ток вещества делят на: электролиты неэлектролиты
- 3. ЭЛЕКТРОЛИТЫ Растворимые соли Растворимые кислоты Растворимые основания (щёлочи) Дом задание пар.35 стр. 152 №5
- 4. Выпишите в столбик формулы электролитов 1 вариант: HNO2, MgSO4, AgCl, SO2, Fe(OH)3, CuO, Ba(OH)2 , H2CO3,
- 5. Проводники электрического тока Металлы Носители тока: свободные электроны Электролиты Носители тока: ?
- 6. 1887г Иван Алексеевич Каблуков Сванте Аррениус ТЕОРИЯ электролитической диссоциации
- 7. Основоположники ТЭД Химия 8-11 класс. Виртуальная лаборатория (№ 22718) 1859-1927 гг. Шведский физико-химик. Автор теории электролитической
- 8. Основоположники ТЭД 1857-1942 гг. Работы относятся преимущественно к электрохимии неводных растворов. Автор учебников по неорганической и
- 9. Анимационный ролик «Механизм электролитической диссоциации» (№125036)
- 10. Молекула воды диполь
- 11. Процесс электролитической диссоциации
- 12. Гидратация- основная причина электролитической диссоциации Гидратация - это взаимодействие частиц электролита с молекулами воды.
- 13. Проводники электрического тока Металлы Носители тока: свободные электроны Электролиты Носители тока: гидратиро- ванные ионы Процесс распада
- 14. ЭТАП 4 Подведение итогов урока Какие утверждения верны: (запишите на полях номера верных утверждений) электролиты проводят
- 15. Электролиты по степени электролитической диссоциации Сильные - практически полностью распадаются на ионы. все растворимые соли сильные
- 16. Уравнения электролитической диссоциации кислот HCl → H + + Cl - HNO3 → H + +
- 17. Уравнения электролитической диссоциации щелочей NaOH → Na+ + OH- KOH → K+ + OH- Ca (OH)2
- 19. Скачать презентацию















 Вибратор Герца
Вибратор Герца Банк российских и зарубежных мультимедийных средств обучения по физике
Банк российских и зарубежных мультимедийных средств обучения по физике Оптические приборы
Оптические приборы Исследование гиратора на основе слоистой структуры феррит никеля–метглас–цирконат-титанат свинца
Исследование гиратора на основе слоистой структуры феррит никеля–метглас–цирконат-титанат свинца Лекция 1-2. Основы механики электропривода
Лекция 1-2. Основы механики электропривода Презентация по физике "Трение" - скачать бесплатно
Презентация по физике "Трение" - скачать бесплатно Волновая функция и ее физический смысл
Волновая функция и ее физический смысл Петрофизика в свете геофизики
Петрофизика в свете геофизики Исследование магнитоупругих колебаний в магнитной пленке при сверхбыстром лазерном возбуждении с использованием техники
Исследование магнитоупругих колебаний в магнитной пленке при сверхбыстром лазерном возбуждении с использованием техники Учитель биологии МБОУ СОШ №19 Куликова И.В. Волгоградская область, г. Волжский
Учитель биологии МБОУ СОШ №19 Куликова И.В. Волгоградская область, г. Волжский  №37 01.02.2022
№37 01.02.2022 Анализ конструкции и ТО первой гидросистемы Ан-148
Анализ конструкции и ТО первой гидросистемы Ан-148 Вынужденные колебания системы с одной степенью свободы
Вынужденные колебания системы с одной степенью свободы Презентация по физике Водопровод. Поршневой жидкостный насос. Гидравлический пресс».
Презентация по физике Водопровод. Поршневой жидкостный насос. Гидравлический пресс».  Электрическая часть электрических станций и подстанций
Электрическая часть электрических станций и подстанций Аттестационная работа. Определение средней скорости черепахи. физика. 7 класс
Аттестационная работа. Определение средней скорости черепахи. физика. 7 класс Решение задач по теме Динамика
Решение задач по теме Динамика Презентация по физике Применение фотоэффекта
Презентация по физике Применение фотоэффекта  Исследование электрического поля с помощью электрической ванны
Исследование электрического поля с помощью электрической ванны Презентация "Внутренняя энергия"
Презентация "Внутренняя энергия" Электростатическое поле в вакууме и его характеристики
Электростатическое поле в вакууме и его характеристики Дрейфовое движение заряженных частиц. (Лекция 3)
Дрейфовое движение заряженных частиц. (Лекция 3) Діелектрики
Діелектрики Волновые свойства света
Волновые свойства света Теплопередача. Теплопроводность. Конвекция. Излучение
Теплопередача. Теплопроводность. Конвекция. Излучение Камера Вильсона
Камера Вильсона  Аттестационная работа. Решение исследовательских задач по физике, как способ формирования исследовательских компетенций учащихся
Аттестационная работа. Решение исследовательских задач по физике, как способ формирования исследовательских компетенций учащихся Электрокинетические явления. Коагуляция. Способы очистки коллоидных растворов. Промышленная очистка воды. (Лекция 10)
Электрокинетические явления. Коагуляция. Способы очистки коллоидных растворов. Промышленная очистка воды. (Лекция 10)